Mechanismus účinku přípravku REAGILA
- Mechanismus účinku kariprazinu není přesně znám.1
- Terapeutický účinek kariprazinu může být zprostředkován kombinaci parciálně agonistického působení na dopaminových D3 a D2 receptorech a serotoninových 5‑HT1A receptorech a antagonistického působení na serotoninových 5‑HT2B receptorech.1
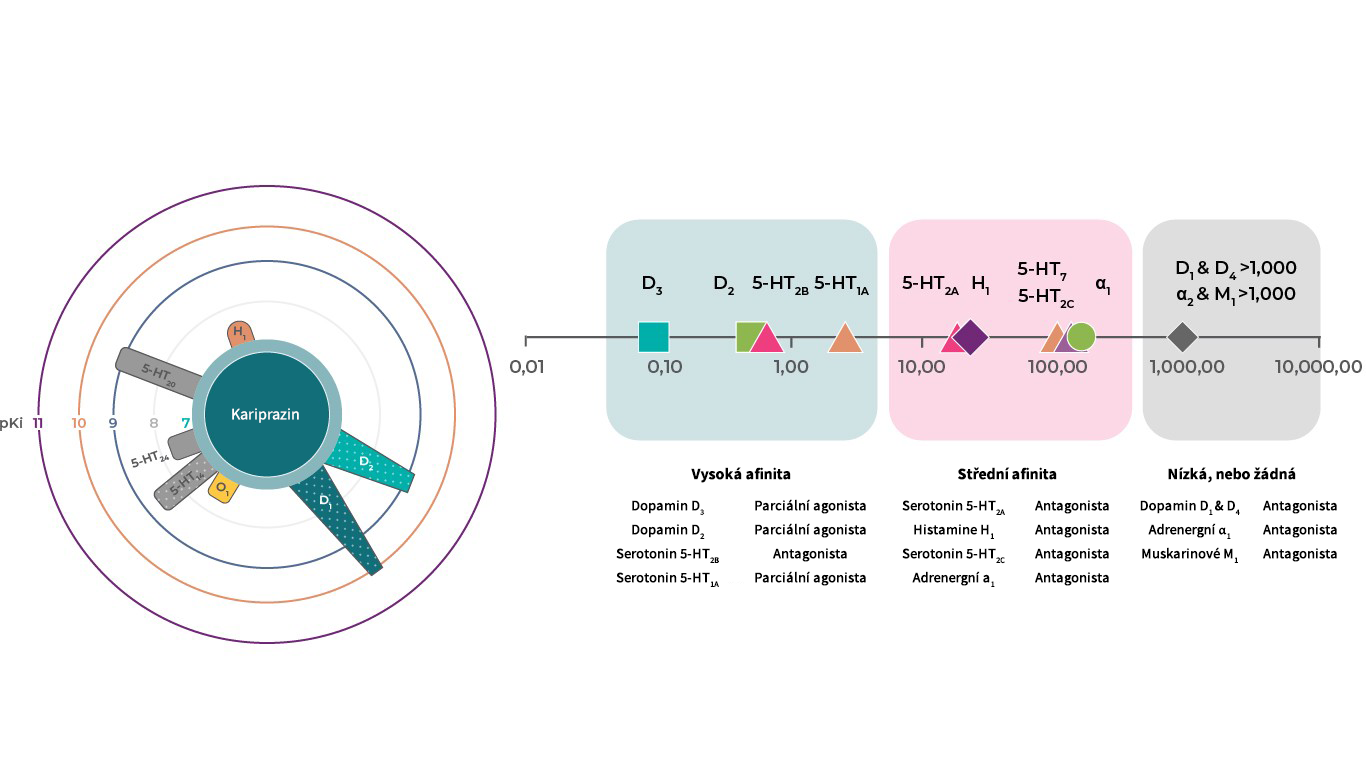
- Kariprazin má nízkou afinitu k serotoninovým 5‑HT2C a adrenergním α1 receptorům a žádnou patrnou afinitu k cholinergním muskarinovým receptorům.1
- Kariprazin má 2 hlavní aktivní metabolity, desmethyl‑kariprazin a didesmethyl‑kariprazin, které mají podobný profil in vitro vazeb na receptory funkční aktivitu jako mateřský lék.1
V této části
Mechanismus účinku všech antipsychotik, včetně kariprazinu, není zcela znám.1 Nicméně na základě jeho receptorového profilu a řady studií zahrnujících in vivo preklinické studie a studie s PET u lidí máme dostatek důkazů, které objasňují hlavní faktory podílející se na jeho mechamismu účinku.
Receptorový profil kariprazinu
Kariprazin má vysokou afinitu k dopaminovým D3 a D2 receptorům a také k serotoninovým 5‑HT2B a 5‑HT1A receptorům, střední afinitu k 5‑HT2A, histaminovým H1 a sigma σ1 receptorům, nízkou afinitu k serotoninovým 5‑HT2C a adrenergním α1 receptorům a žádnou patrnou afinitu k cholinergním muskarinovým receptorům.1,2 Předpokládá se, že terapeutický účinek kariprazinu je zprostředkován kombinací jeho parciálně agonistického působení na dopaminových D3, D2 a serotoninových 5‑HT1A receptorech a antagonistického působení na 5‑HT2B receptorech.1
Literatura: Upraveno podle Kiss. J Pharmacol Exp Ther 2010.333:328–340; Partial agonism is represented with dots, circles show pKi values.2
Antipsychotika jsou obecně považována za účinná proti pozitivním symptomům schizofrenie, zatímco v léčbě kognitivního deficitu a negativních symptomů spojených se schizofrenií je jejich účinnost nižší. Výsledky u zvířecích modelů naznačují, že v regulaci kognice, nálady a sociálních funkcí hrají důležitou roli dopaminové D3 receptory.3 Nejnovější dostupná antipsychotika mají nižší afinitu k D3 receptorům vůči relativně vysoké afinitě samotného dopaminu k D3 receptorům, což je důvod proč neobsazují dopaminové D3 receptory v živém mozku.3 Na druhé straně je kariprazin mezi antipsychotiky jedinečný tím, že má větší vazebnou sílu k D3 receptorům než samotný dopamin, což znamená, že účinkem podání kariprazinu je blokáda D3 receptorů.4-8 Blokáda D3 receptorů má hypoteticky u pacientů se schizofrenií prokognitivní a antidepresivní účinky a účinky proti negativním symptomům.3 Kariprazin prokázal účinnost u behaviorálních preklinických modelů negativních symptomů, symptomů poruch nálady a kognitivního zhoršení.9–14 Účinnost byla u těchto zvířecích modelů minimálně zčásti závislá na jeho aktivitě na dopaminových D3 receptorech, protože jeho účinky na anhedonii a kognitivní zhoršení byly zjevné u myší divokého typu, ale nikoiv u myší s vyřazenými D3 receptory.10,14
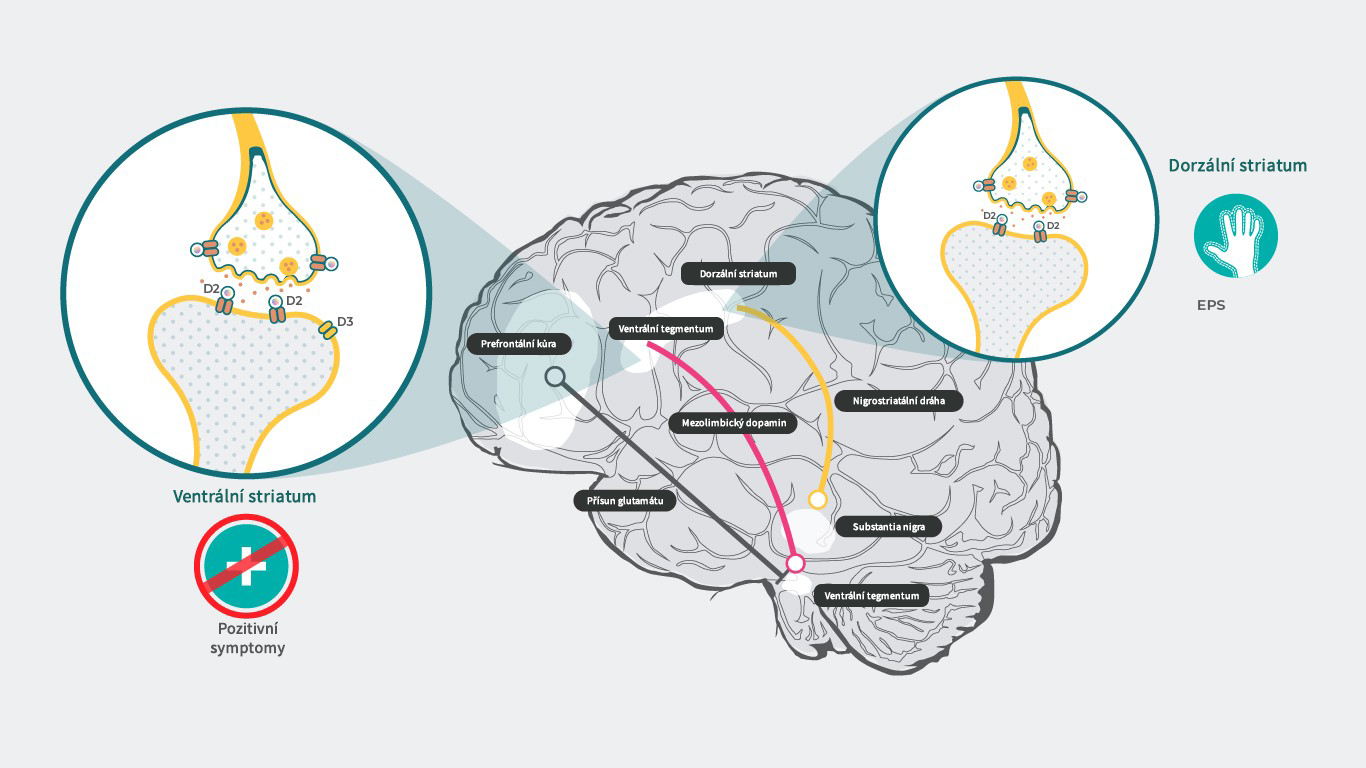
Obsazenost receptorů kariprazinem
Ve farmakologicky účinných dávkách vykázal kariprazin relativně malou obsazenost D3 i D2 receptorů, jak ukázaly neklinické studie in vivo a studie s PET u lidí.15 U pacientů se schizofrenií byla při dávkách kariprazinu v terapeutickém rozmezí pozorována na dávce závislá obsazenost dopaminových D3 a D2 receptorů.1 V oblastech mozku s vyšší expresí D3 receptorů vykázal kariprazin větší preferenční obsazenost D3 receptorů než D2 receptorů.15 Afinita k D3 receptorům je u mnoha léků přibližně stejná jako jejich afinita k D2 receptorům, je ale většinou nižší než afinita dopaminu k D3 receptorům.3 Proto účinky připisované blokádě D3 receptorů nemohou být spojeny s žádným jiným lékem než s kariprazinem, protože v živém mozku v přítomnosti přirozeného dopaminu žádné antipsychotikum než kariprazin D3 receptory neblokuje.3,4 Pokud se týká bezpečnosti, u parciálního agonisty by potenciálně nemělo docházet k blokádě nigrostriatální nebo tuberoinfundibulární dráhy, která je spojena s extrapyramidovými symptomy (EPS) a zvýšenou hladinou prolaktinu.16 Takže teoreticky by měl kariprazin vyvolávat méně vedlejších účinků tohoto typu. Nicméně v klinických studiích bylo prokázáno, že to platí o hladině prolaktinu, která se v odpovědi na podání cariprazinu nezvyšuje,17 Bylo ovšem zvýšení incidence EPS/akatizie.16
Literatura: Upraveno podle Stahl SM. CNS Spectrums (2017), 22, 375–384.3 ; Howes J Psychopharmacol. 2015 February; 29(2): 97–115.18
In vitro vykazuje kariprazin účinky parciálního agonisty D3 receptorů.1 Vzhledem k tomu, že většina D3 receptorů se nachází v oblastech mozku, kde je u schizofrenie hyperdopaminergní stav (tj. v mezolimbickém dopaminergním systému),15,18 působí kariprazin na tyto receptory jako funkční antagonista. Antagonistické působení na D3 receptory je spojeno s prokognitivními a antidepresivními účinky a účinky proti negativním symptomům.3 Matoucí je, že stejné účinky také souvisejí s korovými funkcemi, kde je při schizofrenii hypodopaminergní stav.18 Zde tedy vyvstává otázka, jak kariprazin normalizuje tento hypodopaminergní stav blokádou D3 receptorů?
1. hypotéza: Literatura: Upraveno podle Howes J Psychopharmacol. 2015 February; 29(2): 97–115.18; Stahl SM. CNS Spectrums (2017), 22, 375–384.3
2. hypotéza: Literatura: Adapted from Bouthenet et al. Brain research 1991.564, 203-21928; Gurevich, Neuropsychopharmacology 1999. 20, 60-80.29; Loiseau, Eur Neuropsychopharmacol 2009.19, 23-33.30; Watson, D.J. Neuropsychopharmacology 2012.37, 770-786.31; Clarkson, J Neurosci 2017.37, 5846-5860.32; Yang, S. Cell Rep 2016.16, 1518-1526.33; Neill, J.C. Eur Neuropsychopharmacol 2016. 26, 3-14.11; Zimnisky, R. Psychopharmacology (Berl) 2013.226, 91-100.14
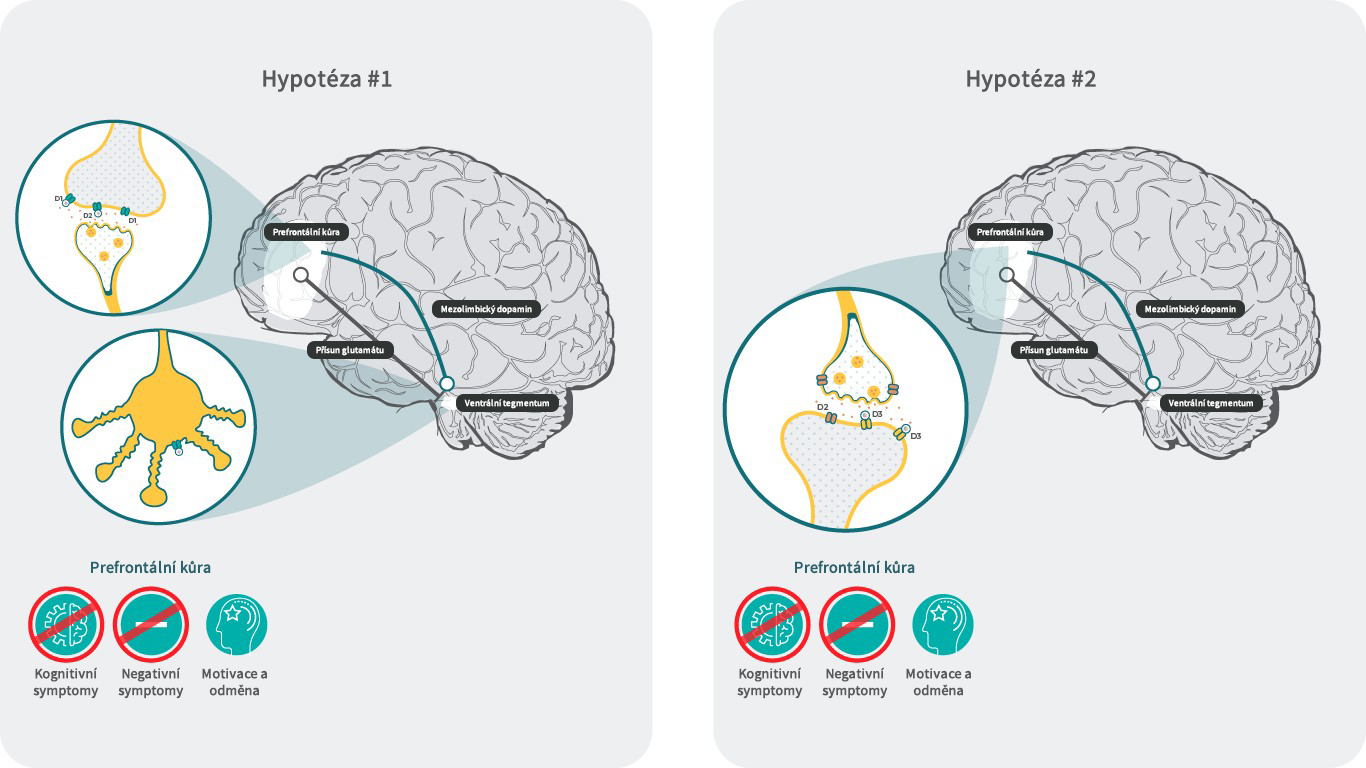
Hypotéza č. 1: Zvýšená neurotransmise z VTA do PFC
Negativní symptomy a kognitivní zhoršení jsou spojeny s hypodopaminergním stavem v prefrontálním kortexu (PFC).18 Příčinou toho může být snížené vyplavování dopaminu v PFC z důvodu aktivace presynaptických dopaminových D3 autoreceptorů ve ventrální tegmentální oblasti (VTA) s projekcí do PFC.3 Předpokládá se, že za těchto podmínek může antagonista/parciální agonista D3 receptorů blokovat inhibici těchto neuronů, což dále vede ke zvýšení hladiny dopaminu v PFC a normalizuje hypodopaminergní stav.3 Zvýšení dopaminu může zvrátit hypodopaminergní stav a vést ke zmírnění negativních symptomů a zlepšení kognice prostřednictvím aktivace D1 receptorů v PFC, které nejsou při nízké hladině dopaminu aktivní z důvodu nízké aktivity dopaminu k těmto receptorům.3
Ačkoliv přesný mechanismus účinku kariprazinu a vlastně ani ostatních antipsychotik stále není znám, výsledky preklinických pokusů s kariprazinem tuto hypoztézu příliš nepodporují.19-26 Je ale možné, že u lidí jsou účinky jiné, protože mechanismus a funkční důsledky somatodendritické dopaminové transmise ve VTA se podle publikovaných prací u různých druhů liší. Lze očekávat, že in vivo budou mít tyto rozdíly dopad na aktivitu mezokortikolimbického dopaminového systému a následné terminální vyplavení.27
Hypotéza č. 2: Postsynaptická vazba na D3 receptory v PFC
I přes relativně nízkou expresi D3 receptorů v PFC28-29 důkazy naznačují, že D3 receptory v PFC mohou modulovat funkci PFC a ovlivňovat kognici.5,6
U hlodavců vedle lokální infúze antagonistů D3 receptorů do PFC k účinnosti na zvířecí model negativních symptomů a narušení kognice. Účinnost nebyla pozorována v nucleus accumbens (NAc) ani ve striatu,30,31 což naznačuje, že antagonisticé působení naD3 receptorech má lokálně v PFC prokognitivní účinky. Schopnost D3 receptorů modulovat náladu a kognitivní funkce i přes svou nízkou expresi může souviset se specializovaným umístěním D3 receptorů v PFC. Ukázalo se, že D3 receptory hrají výraznou roli v regulaci excitability v 5. vrstvě pyramidových buněk v PFC32. Další studie zjistila, že agonisté D3 receptorů potlačují excitabilitu kanálu Cav3 iniciálního segmentu axonu mechanismem závislým na arestinu.33 Společně tyto výsledky naznačují, že antagonistické působení kariprazinu na postsynaptických D3 receptorech v PFC by mohlo přispívat k účinnosti na negativní symptomy a kognici modulací potenciálů glutamátových neuronů a transmise glutamátu. To dále podporují i příznivá zjištění, že kariprazin dokázal u zvířecích behaviorálních modelů odvrátit kognitivní zhoršení navozené PCP.11,14
Metabolity kariprazinu
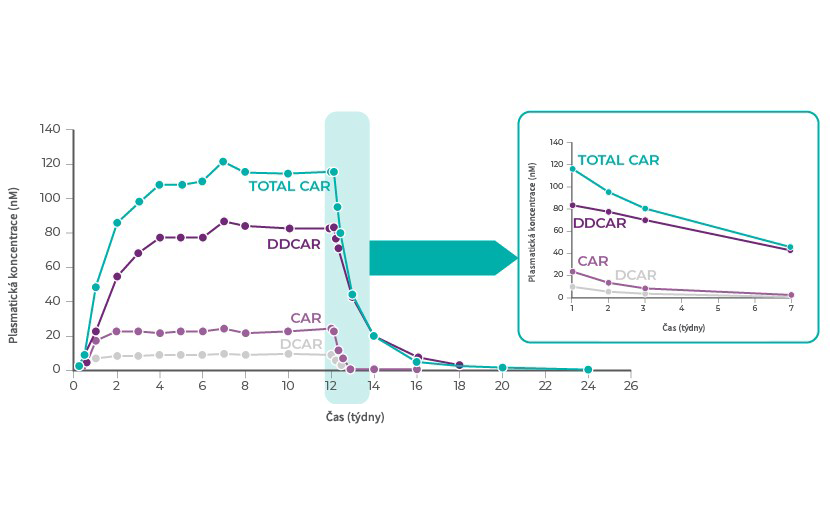
Cariprazin má 2 farmakologicky aktivní metabolity, jejichž aktivita je podobná kariprazinu, desmethyl‑kariprazin (DCAR) a didesmethyl‑kariprazin (DDCAR).1 Celková expozice kariprazinu (molární součet kariprazinu s DCAR a DDCAR) se blíží 50 % expozice v ustálením stavu přibližně po 1 týdnu každodenního podávání a 90 % ustáleného stavu je dosaženo po 3 týdnech. V ustáleném stavu je expozice DDCAR přibližně 2–3krát vyšší než expozice kariprazinu a expozice DCAR činí přibližně 30 % expozice kariprazinu.1
kariprazin, DCAR a DDCAR jsou primárně vylučovány jaterním metabolismem (CYP3A4 a CYP2D6). Poločas účinnosti je asi 2 dny u kariprazinu a DCAR, 8 dní u DDCAR a ~1 týden u celkového kariprazinu. Plazmatická koncentrace celkového kariprazinu po vysazení dávkování postupně klesá, přičemž poklesu o 50 % je dosaženo přibližně za 1 týden a poklesu >90 % za 3 týdny.1
Literatura: Upraveno podle Nakamura, T. et al. Clinical pharmacology study of cariprazine (MP-214) in patients with schizofrenie (12-week treatment). Drug Des. Devel. Ther. 10, 327–338 (2016)34.
Literatura
- Reagila SmPC.
- Kiss, B. et al. Cariprazine (RGH-188), a dopamine D3 receptor-preferring, D 3/D2 dopamine receptor antagonist-partial agonist antipsychotic candidate: In vitro and neurochemical profile. J. Pharmacol. Exp. Ther. 333, 328–340 (2010).
- Stahl, S. M. Drugs for psychosis and mood: Unique actions at D3, D2, and D1 dopamine receptor subtypes. CNS Spectr. 22, 375–384 (2017).
- Stahl, S. M. Mechanism of action of cariprazine. CNS Spectr. 21, 123–127 (2016).
- Gross, G. & Drescher, K. The role of dopamine D 3 receptors in antipsychotic activity and cognitive functions. in Handbook of Experimental Pharmacology (eds. Geyer, M. A. & Gross, G.) 168–210 (2012). doi:10.1007/978-3-642-25758-2_7
- Nakajima, S. et al. The potential role of dopamine D3 receptor neurotransmission in cognition. Eur. Neuropsychopharmacol. 23, 799–813 (2013).
- Leggio, G. M., Bucolo, C., Platania, C. B. M., Salomone, S. & Drago, F. Current drug treatments targeting dopamine D3 receptor. Pharmacol. Ther. 165, 164–177 (2016).
- Ellenbroek, B. A. & Cesura, A. M. Antipsychotics and the dopamine–serotonin connection. in Topics in Medicinal Chemistry (eds. Celanire, S. & Poli, S.) 13, 1–49 (Springer, Cham, 2014).
- Barnes, S. A. et al. The Effects of Cariprazine and Aripiprazole on PCP-Induced Deficits on Attention Assessed in the 5-Choice Serial Reaction Time Task. Psychopharmacology (Berl). 235, 1403–1414 (2018).
- Duric, V. et al. Cariprazine exhibits anxiolytic and dopamine D3 receptor-dependent antidepressant effects in the chronic stress model. Int. J. Neuropsychopharmacol. 20, 788–796 (2017).
- Neill, J. C. et al. Effects of cariprazine, a novel antipsychotic, on cognitive deficit and negative symptoms in a rodent model of schizofrenie symptomatology. Eur. Neuropsychopharmacol. 26, 3–14 (2016).
- Papp, M. et al. Attenuation of anhedonia by cariprazine in the chronic mild stress model of depression. Behav. Pharmacol. 25, 567–574 (2014).
- Watson, D. J. G. et al. The dopamine D 3 -preferring D 2 /D 3 dopamine receptor partial agonist, cariprazine, reverses behavioural changes in a rat neurodevelopmental model for schizofrenie. Eur. Neuropsychopharmacol. 26, 208–224 (2016).
- Zimnisky, R. et al. Cariprazine, a dopamine D3-receptor-preferring partial agonist, blocks phencyclidine-induced impairments of working memory, attention set-shifting, and recognition memory in the mouse. Psychopharmacology (Berl). 226, 91–100 (2013).
- Girgis, R. R. et al. Preferential binding to dopamine D3 over D2 receptors by cariprazine in patients with schizofrenie using PET with the D3/D2 receptor ligand [11C]-(+)-PHNO. Psychopharmacology (Berl). 233, 3503–3512 (2016).
- Lieberman, J. A. Dopamine partial agonists: A new class of antipsychotic. CNS Drugs 18, 251–267 (2004).
- Nasrallah, H. A. et al. The safety and tolerability of cariprazine in long-term treatment of schizofrenie: A post hoc pooled analysis. BMC Psychiatry (2017) doi:10.1186/s12888-017-1459-z.
- Howes, O., McCutcheon, R. & Stone, J. Glutamate and dopamine in schizofrenie: An update for the 21st century. J. Psychopharmacol. 29, 97–115 (2015).
- Kehr, J. et al. Effects of cariprazine on extracellular levels of glutamate, GABA, dopamine, noradrenaline and serotonin in the medial prefrontal cortex in the rat phencyclidine model of schizofrenie studied by microdialysis and simultaneous recordings of locomotor acti. Psychopharmacology (Berl). 235, 1593–1607 (2018).
- Gobert, A. et al. Functional correlates of dopamine D3 receptor activation in the rat in vivo and their modulation by the selective antagonist, (+)-S 14297: II. Both D2 and ‘silent’ D3 autoreceptors control synthesis and release in mesolimbic, mesocortical and nigrostriata. J. Pharmacol. Exp. Ther. 275, 899–913 (1995).
- Millan, M. J. et al. S18616, a highly potent spiroimidazoline agonist at α2-adrenoceptors: II. Influence on monoaminergic transmission, motor function, and anxiety in comparison with dexmedetomidine and clonidine. J. Pharmacol. Exp. Ther. 295, 1206–1222 (2000).
- Reavill, C. et al. Pharmacological actions of a novel, high-affinity, and selective human dopamine D 3 receptor antagonist, SB-277011-A. J. Pharmacol. Exp. Ther. 294, 1154–1165 (2000).
- Delcourte, S. et al. The novel atypical antipsychotic cariprazine demonstrates dopamine D2 receptor-dependent partial agonist actions on rat mesencephalic dopamine neuronal activity. CNS Neurosci. Ther. 24, 1129–1139 (2018).
- Etievant, A., Bétry, C., Arnt, J. & Haddjeri, N. Bifeprunox and aripiprazole suppress in vivo VTA dopaminergic neuronal activity via D2 and not D3 dopamine autoreceptor activation. Neurosci. Lett. 460, 82–86 (2009).
- Koeltzow, T. E. et al. Alterations in dopamine release but not dopamine autoreceptor function in dopamine D3 receptor mutant mice. J. Neurosci. 18, 2231–2238 (1998).
- Tepper, J. M., Sun, B. C., Martin, L. P. & Creese, L. Functional roles of dopamine D2 and D3 autoreceptors on nigrostriatal neurons analyzed by antisense knockdown in vivo. J. Neurosci. 17, 2519–2530 (1997).
- Courtney, N. A., Mamaligas, A. A. & Ford, C. P. Species differences in somatodendritic dopamine transmission determine D2-autoreceptor-mediated inhibition of ventral tegmental area neuron firing. J. Neurosci. 32, 13520–13528 (2012).
- Bouthenet, M. L. et al. Localization of dopamine D3 receptor mRNA in the rat brain using in situ hybridization histochemistry: comparison with dopamine D2 receptor mRNA. Brain Res. 564, 203–219 (1991).
- Gurevich, E. V. & Joyce, J. N. Distribution of dopamine D3 receptor expressing neurons in the human forebrain comparison with D2 receptor expressing neurons. Neuropsychopharmacology 20, 60–80 (1999).
- Loiseau, F. & Millan, M. J. Blockade of dopamine D3 receptors in frontal cortex, but not in sub-cortical structures, enhances social recognition in rats: Similar actions of D1 receptor agonists, but not of D2 antagonists. Eur. Neuropsychopharmacol. 19, 23–33 (2009).
- Watson, D. J. G. et al. Selective blockade of dopamine D 3 receptors enhances while D 2 receptor antagonism impairs social novelty discrimination and novel object recognition in rats: A key role for the prefrontal cortex. Neuropsychopharmacology 37, 770–786 (2012).
- Clarkson, R. L., Liptak, A. T., Gee, S. M., Sohal, V. S. & Bender, K. J. D3 receptors regulate excitability in a unique class of prefrontal pyramidal cells. J. Neurosci. 37, 5846–5860 (2017).
- Yang, S. et al. β-Arrestin-Dependent Dopaminergic Regulation of Calcium Channel Activity in the Axon Initial Segment. Cell Rep. 16, 1518–1526 (2016).
- Nakamura, T. et al. Clinical pharmacology study of cariprazine (MP-214) in patients with schizofrenie (12-week treatment). Drug Des. Devel. Ther. 10, 327–338 (2016).
CNS Spectrums
Mechanism of action of cariprazine.
REAGILA U AKUTNÍ SCHIZOFRENIENÁŠ PŘÍPRAVEK U AKUTNÍ SCHIZOFRENIE
Když je stanovena diagnóza schizofrenie, musí lékaři, pacienti a rodinní příslušnící provést důležité rozhodnutí o terapii. I když by člověk intuitivně řekl, žeKdyž je stanovena diagnóza schizofrenie, musí lékaři, pacienti a rodinní příslušnící provést důležité rozhodnutí o terapii. I když by člověk intuitivně řekl, že
více…REAGILA A KAŽDODENNÍ FUNGOVÁNÍNÁŠ PŘÍPRAVEK A KAŽDODENNÍ FUNGOVÁN…
U pacientů se schizofrenií musí být zmírnění negativních symptomů provázeno zlepšením fungování pacienta, aby mohla být změna považována za klinicky relevantní.U pacientů se schizofrenií musí být zmírnění negativních symptomů provázeno zlepšením fungování pacienta, aby mohla být změna považována za klinicky relevantní.
více…